- HOME
- 研究/血液グループ
血液グループ

骨髄異形成症候群(MDS)・白血病の分子メカニズム解明
MDS・白血病は、造血幹細胞/造血前駆細胞がさまざまな遺伝子変異を獲得することで発症します。近年の網羅的遺伝子解析により、様々な造血器腫瘍でDNAメチル化やヒストン修飾に関わるエピゲノム因子が広範に異常をきたしていることが明らかとなってきました。当研究室では、造血器腫瘍幹細胞の生成・維持に関わるエピゲノム因子に注目し、その生理的機能解析を進めるとともに、その機能異常がいかに造血器腫瘍の発症につながるのかを研究しています。
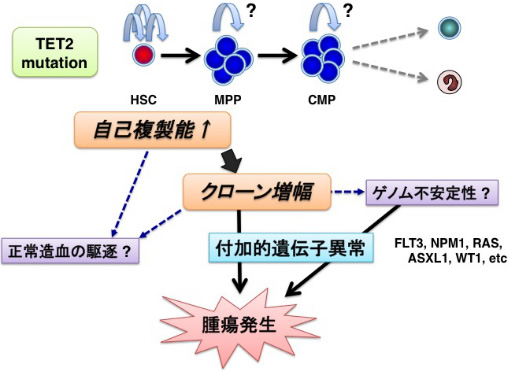
TET2はDNAの脱メチル化に関わるエピゲノム因子で、白血病や骨髄異形成症候群、悪性リンパ腫などで高頻度(数%~50%)に変異を起こしていることが知られています。我々はTET2ノックアウトマウスの解析から、TET2が造血幹細胞機能や血球分化に深く関わっていることを明らかにしました。またTET2は加齢にともなうクローン造血の主要な原因遺伝子であることも報告されています。我々は現在ノックアウトマウスや患者検体を用いて、TET2変異を基盤としたMDS発症のより詳細な分子メカニズムを明らかにすべく研究を進めています。さらに、TET2を標的にした新規MDS治療薬の開発も進めています。
またこのような基礎研究を臨床に還元するため、当研究室では白血病・MDSの遺伝子変異を網羅的に解析するゲノムシーケンスを立ち上げ臨床に役立てています。
<参考文献>
- Kunimoto H, Fukuchi Y, Sakurai M, Sadahira K, Ikeda Y, Okamoto S, Nakajima H: Tet2 disruption leads to enhanced self-renewal and altered differentiation of fetal liver hematopoietic stem cells. Scientific Reports, 2:273, 2012.
- Kunimoto H, Fukuchi Y, Sakurai M, Takubo K, Okamoto S, Nakajima H: Tet2-mutated myeloid progenitors possess aberrant in vitro self-renewal capacity. Blood, 123:2897-9, 2014.
- Nakajima H, Kunimoto H: TET2 as an epigenetic master regulator for normal and malignant hematopoiesis (review). Cancer Science, 105:1093-9, 2014.
- Kunimoto H, Nakajima H.: Epigenetic dysregulation of hematopoietic stem cells and preleukemic state. Int J Hematol. 106: 34-44, 2017. Review.
- Kunimoto H, Meydan C, Nazir A, Whitfield J, Shank K, Rapaport F, Maher R, Pronier E, Meyer SC, Garrett-Bakelman FE, Tallman M, Melnick A, Levine RL, Shih AH.: Cooperative Epigenetic Remodeling by TET2 Loss and NRAS Mutation Drives Myeloid Transformation and MEK Inhibitor Sensitivity. Cancer Cell. 2018 Jan 8;33(1):44-59.e8.
- ゲノム・エピゲノム異常からみた骨髄異形成症候群と急性白血病の病態:中島秀明 血液内科 第74巻第5号, p.629-636, 2017年5月
- 中島秀明:AMLのゲノム異常.臨床血液60(6):584-593, 2019
- Nakajima H.: Molecular Pathogenesis and Treatment of Myelodysplastic Syndromes. Intern Med. 2020 Feb 1.
ミトコンドリアダイナミックスによる造血幹細胞機能制御
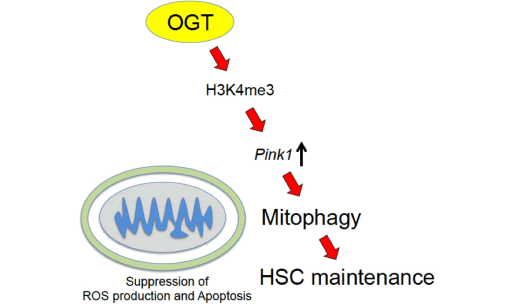
造血幹細胞(HSC)の機能制御には、代謝、低酸素応答、細胞内シグナル、細胞周期、転写因子、ミトコンドリア制御など様々なメカニズムが関わっています。このうちミトコンドリアは細胞のエネルギー産生を行うだけでなく、アポトーシスや活性酸素産生にも深く関わっており、その制御はHSCにとって極めて重要です。
我々の研究室ではミトコンドリアの品質管理に関わるマイトファジーという仕組みを制御する分子として、OGTと呼ばれる糖鎖修飾酵素を同定しました。OGTはマイトファジー制御を介してHSC維持に必須の役割を果たしており、OGTが失われるとHSCは枯渇してしまいます。現在、OGTと白血病幹細胞、自己免疫性疾患との関わりについても研究を進めています。
<参考文献>
- Koichi Murakami, et al.: Metabolic regulation of hematopoietic stem cells by O-linked N-acetylglucosamine transferase. 47th Annual meeting of Internationl Society of Experimental Hematology, Los Angeles, 2018. 12.
- Koichi Murakami, et al.: Regulation of mitophagy by O-linked N-acetylglucosamine transferase is essential for hematopoietic stem cell maintenance. 60th ASH annual meeting and exposition, San Diego, 2018, 12.
血球転写因子の異常と白血病発症の分子メカニズム
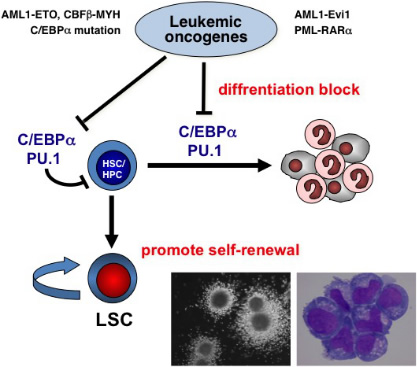
白血病は、白血病幹細胞(leukemic stem cell; LSC)と呼ばれるごく少数の細胞により発症し維持されていることが知られています。しかしながら、様々な白血病原因遺伝子(染色体転座融合遺伝子、癌遺伝子/癌抑制遺伝子の変異、など)がいかにしてLSCの生成・維持に関与しているのか、その分子メカニズムは不明のままです。
血球特異的転写因子であるC/EBPaとPU.1は骨髄系分化に重要な働きをしており、これらの機能が抑制されると骨髄系分化に障害をきたすことが知られています。我々は以前、C/EBPaやPU.1が血球分化だけでなく造血幹細胞(HSC)の自己複製にも深く関わっていることを見いだし報告しました。C/EBPaやPU.1は非常に多くの白血病原因遺伝子の標的になっているため、我々はC/EBPa, PU.1の機能異常が正常HSCの自己複製の異常を引き起こし、それがLSC生成につながっているのではないかと考えています。現在我々は、RUNX1関連白血病、MLL関連白血病など様々な白血病において、C/EBPa, PU.1を含むどのような転写因子が障害され白血病発症に至っているのかを、白血病モデルマウス、遺伝子改変マウスなどを用いて解析しています。将来的には、これらの研究成果をもとにLSCを標的にした新たな治療薬を開発したいと考えています。
<参考文献>
- Truong BT, Lee YJ, Lodie TA, Park DJ, Perrotti D, Watanabe N, Koeffler HP, Nakajima H, Tenen DG, Kogan SC: CCAAT/Enhancer binding proteins repress the leukemic phenotype of acute myeloid leukemia. Blood. 101:1141-8, 2003.
- Ono R, Nakajima H, Ozaki K, Kumagai H, Kawashima T, Taki T, Kitamura T, Hayashi Y, Nosaka T.: Dimerization of MLL fusion proteins and FLT3 activation synergize to induce multiple-lineage leukemogenesis. J Clin Invest. 115:919-929, 2005.
- Watanabe-Okochi N, Kitaura J, Ono R, Harada H, Harada Y, Komeno Y, Nakajima H, Nosaka T, Inaba T, Kitamura T: AML1 mutations induced MDS and MDS/overt leukemia in mouse BMT model. Blood, 11:4297-308, 2008.
- Matsushita H, Nakajima H, Nakamura Y, Tsukamoto H, Tanaka Y, Yabe M, Asai S, Ono R, Nosaka T, Sugita K, Morimoto A, Hayashi Y, Hotta T, Ando K, Miyachi H: C/EBPa and C/EBPe induce the monocytic differentiation of myelomonocytic cells with the MLL-chimeric fusion gene. Oncogene, 27:6749-60, 2008.
- Nakajima H, Tamura T, Ito M, Shibata F, Kuroda K, Fukuchi Y, Watanabe N, Kitamura T, Ikeda Y, Handa M: SHD1 is a novel cytokine-inducible, negative feedback regulator of STAT5-dependent transcription. Blood, 113:1027-36, 2009.
- C/EBPaと血球分化:中島秀明 血液・腫瘍科 第55巻、第1号、p.117-124、2007(科学評論社)

